 引言
引言
化學元素
 引言
引言
完成了火大、風大、水大三種元素的全新成佛訓練之後,
進入第四個地大元素的空間研究,經過數天的觀察之後,
否則就無法配合前三種元素的訓練效果、和無法獲得真正成佛者的要求效果!
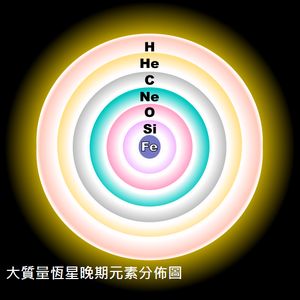
我們應該改從天文科學和化學元素的角度,去開發這種全新的土元素訓練方法。
透過太陽演變的歷史往前推進,當太陽進入二度燃燒或者第三度燃燒時,所含的化學元素開始研究。
…………………………………………………………………………………………………………………………………………………..
氫元素
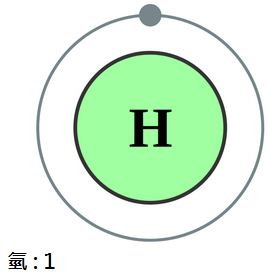
氫是原子序數為1的化學元素,化學符號為H,在元素週期表中編號為「1」。
是最輕的元素,也是宇宙中含量最多的元素,大約佔宇宙非暗物質質量的75%。
主星序上恆星的主要成分都是電漿態的氫。
 性質
性質
單質可燃性、氫氣與氧氣混合而燃燒,放出接近無色的火焰。
氫氣是一種極易燃的氣體,在空氣中體積分數達到4%及以上時即能燃燒。
氫氣以4%至74%的濃度時與空氣混合,
或以5%至95%的濃度時與氯氣混合時是極易爆炸的氣體,
在熱、日光或火花的刺激下易引爆。氫氣的著火點為
純淨的氫氣與氧氣的混合物燃燒時放出紫外線。
氫氣在常溫下可自發與氟氣(冷暗處)以及氯氣(需要光照)
發生劇烈燃燒並爆炸,生成具潛在危險的氟化氫或氯化氫。
同位素
氕為氫最常見的同位素,含有1個質子和1個電子,它是所有核素中唯一不含中子的。
氫有三種天然同位素,分別為氕、氘、氚。這三種同位素分別記作
1H、2H、3H或H、
D、
T。
1H
是氫最常見的同位素,名為「氕」。其豐度大於
99.98%。不含中子,只含一個質子和一個電子。
2H
是氫另外一種穩定的同位素,稱為「氘」。氘核含有一個質子和一個中子。
本質上宇宙中所有的氘原子都被認為是大爆炸過程中產生的,並直至現在沒有發生變化。
氘不具放射性,也無顯著毒性。水中的氕原子被氘原子取代後形成的水分子構成的水稱為重水。
氘及其化合物在化學實驗中可作為無放射性的標記,也作為1H-NMR光譜分析所用的溶劑。
重水是一種中子減速劑和核反應的冷卻劑。氘也是一種潛在的核聚變燃料。
3H
稱為「氚」,含有一個質子和兩個中子。氚有放射性,通過β衰變變為氦-3,其半衰期為
12.32
年。
自然界存在少量氚,是由宇宙射線和大氣層中的氣體作用得到的。核試驗中也會釋放氚。
氚用於核聚變反應,也在地球化學領域中用於測定年代,並可用於自我照明設備。
氚在化學及生物學實驗中可作為同位素示蹤法的標誌。
分布
在地球上和地球大氣中只存在極稀少的游離態氫。在地殼裡,如果按質量計算,氫只佔總質量的1%,
而如果按原子百分數計算,則佔17%。氫在自然界中分布很廣,水便是氫的「倉庫」——以質量百分比計算,
水中含11%的氫;泥土中約有1.5%的氫;石油、天然氣、動植物體也含氫。
在空氣中,氫氣倒不多,約佔總體積的兩百萬分之一。
在整個宇宙中,按原子百分數來說,氫卻是最多的元素。
據研究,在太陽的大氣中,按原子百分數計算,氫佔93%。
在宇宙空間中,氫原子的數目比其他所有元素原子的總和約大100倍。
醫學用途
因於氫氣可以選擇性中和羥基自由基(羥基自由基是生物體毒性最強的自由基),引起國際上的廣泛關注,
大批臨床和基礎醫學學者迅速跟進,至現在已有70餘個疾病類型被證明可以被氫氣有效治療。
世界衛生組織註冊信息中報告,氫氣在人體脂代謝和糖代謝中起到關鍵的調節作用。
…………………………………….
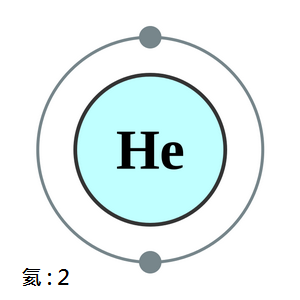
氦(Helium,舊譯作氜)
是一種化學元素,其化學符號是He,原子序數是2,是一種無色的惰性氣體,放電時發深黃色的光。
在常溫下,氦是一種極輕的無色、無臭、無味的單原子氣體。
氦在空氣中含量較少,但在宇宙中是第二豐富的元素,在銀河系佔24%。
 名稱由來
名稱由來
因此定名為「氦」(法文為hélium,英文為helium),源自希臘語意為「太陽」。
在中文裡,晚清時譯作「氜」(讀作「日」),以表示從太陽光中發現的氣態元素。
在1915年,由民國教育部頒布的《無機化學命名草案》
則採用發音與英文更為一致的「氦」,並沿用至今。
分布
氦存在於整個宇宙中,按質量計佔23%。
但在自然界中主要存在於天然氣或放射性礦石中。
在地球大氣層中,氦的濃度十分低,只有5.2萬分之一。
密度只有空氣的7.2分之一,是除了氫以外密度最小的氣體。
性質
氦氣是所有氣體中最難液化的,沸點僅為4.22K,這源於氦極低的極性。
同時,氦是唯一不能在標準大氣壓下固化的物質,也沒有三相點。
基於類似的原因,氦在水中的溶解度也極小,
液氦在溫度降至2.178K時,性質會發生突變,粘度極小,能形成只有幾個原子厚度的薄膜,
發生無粘度流動,成為一種超流體,稱為氦(II),正常的液氦稱作氦(I)。
這種氦(II)的表面張力很小,能沿容器壁向上流動,直到兩邊液面等高。
此時的氦熱傳導性為銅的800倍,成為導熱性能極佳的熱導體。其比熱容、壓縮性等都是反常的。
液氦的另一重要性質是能穿透許多常見材料,如PVC、橡膠與大部分玻璃,所以玻璃杜瓦瓶無法用於液氦的操作。
氦的化學性質非常不活潑,一般狀態下不會和其他物質發生反應,目前檢測到的氦化合物僅痕量發現於質譜中,且不穩定。
用途
由於氦很輕,而且不易燃,因此它可用於填充飛艇、氣球、溫度計、電子管、潛水服等。
也可用於原子反應爐和加速器、雷射器、冶煉和焊接時的保護氣體,還可用來填充燈泡和霓虹燈管,也用來製造泡沫塑料。
由於氦在血液中的溶解度很低,因此可以加到氧氣中防止減壓病,作為潛水員的呼吸用氣體,或用於治療氣喘和窒息。
液體氦的溫度(
液態氦還常用做冷卻劑和製冷劑。在醫學中,用於氬氦刀以治療癌症。
它還可以用作人造大氣層和鐳射媒體的組成部分。氦氣可以用於保存屍體,毛澤東水晶棺內的氣體即為氦氣。
………………………………………………..
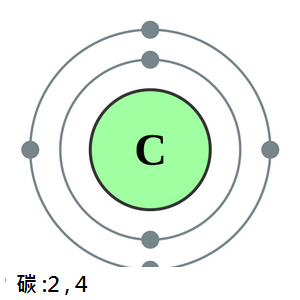
碳(Carbon,拉丁文意為煤炭)
是一種化學元素,符號為C,原子序數為6,位於元素週期表中的IV
A族,屬於非金屬。
每個碳原子有四顆能夠進行鍵合的電子,因此其化合價通常為4。碳是少數幾個自遠古就被發現的元素之一。
 碳的同素異形體有幾種,最常見的包括:石墨、鑽石及無定形碳。
碳的同素異形體有幾種,最常見的包括:石墨、鑽石及無定形碳。
這些同素異形體之間的物理性質,包括外表、硬度、電導率等等,都具有極大的差異。
在正常條件下,鑽石、碳奈米管和石墨烯的熱導率是已知材質中最高的。
所有碳的同素異形體在一般條件下都呈固態,其中石墨的熱力學穩定性最高。
它們不易受化學侵蝕,甚至連氧都要在高溫下才可與其反應。
碳是所有元素中化合物種類最多的,目前有近一千萬種已記錄的純有機化合物,
但這只是理論上可以存在的化合物中的冰山一角。
碳的豐度在地球地殼中排列第15,並在全宇宙中排列第4,名列氫、氦和氧之下。
由於碳元素極為充沛,再加上它在地球環境下所能產生的聚合物種類極為繁多,
因此碳是地球上所有生物的化學根本。
同素異形體
單原子碳的存活時間極短,因此碳一般以多原子形態穩定存在,這些碳原子的不同排布方式稱為同素異形體。
最常見的三種碳同素異形體為無定形碳、石墨及鑽石。
富勒烯共包括巴基球、碳奈米管、碳奈米芽及碳奈米纖維等。
其他同素異形體還有:藍絲黛爾石、玻璃碳、碳奈米泡沫及直鏈乙炔碳等等。
碳的無定形體是碳原子以非晶體形式不規則排列時形成的玻璃態物質,也就是不具備宏觀晶體結構的石墨。
無定形碳呈粉末狀,是煤炭、煤煙(炭黑)及活性炭的主要成份。
在正常壓力下,碳以石墨的形式存在,其中每個碳原子都和另外三個碳原子鍵合,形成平面六邊形環平鋪結構。
這一種網狀平面結構能夠層疊起來,每層間有弱範德華力。
因此石墨性質柔軟,也可作潤滑劑(因為層與層間能輕易平行滑動)。
由於石墨中每個碳原子都有一顆外層離域電子,共同形成遍佈整個平面的π-雲,
所以電能順著石墨的每個共價鍵合平面上傳導。
因此碳的整體電導率低於大部分金屬。
由於含有離域電子,因此在標準條件下石墨比鑽石更加穩定。
在極高壓力下,碳會形成原子排布更緊密的鑽石,其密度幾乎為石墨的兩倍。
鑽石中的每個碳原子以四面體狀與另外四個碳原子鍵合,形成一個三維密鋪網狀結構。
鑽石晶體屬立方晶系與矽和鍺相同。由於碳-碳共價鍵非常強,因此鑽石是最抗刮損的天然材質。
碳在某些情況下會結晶成藍絲黛爾石。
這一形態為六方晶體,所有碳原子間都以共價鍵鍵合。因此藍絲黛爾石與鑽石特性相近。
存量
碳在全宇宙各元素中總質量排列第四,位於氫、氦和氧之後。碳大量存在於彗星、大部分行星大氣層、太陽以及其他恆星中。
一些隕石含有太陽系還處於原行星盤時所遺留下來的微鑽石。隕石撞擊時的巨大溫度和壓力也會在撞擊坑處形成微鑽石。
宇宙射線會在海拔9至
由於半衰期只有5730年,所以該同位素在古老岩石中幾乎絕跡,但會在大氣高層(低平流層及高對流層)中經宇宙射線和氮間的反應而不斷產生。
這就是放射性碳定年法的原理。該定年法可測量年齡在4萬年以下的含碳物質。
星體內部核合成
碳原子核的合成需要在巨星或超巨星內部,通過3顆α粒子(氦原子核)幾乎同時互相撞擊而形成,稱為3氦過程。
進一步與氫或氦融合後分別產生的鋰-5和鈹-8都很不穩定,因此會迅速衰變回較小的原子核。
大爆炸後的宇宙迅速膨脹、冷卻,因此大爆炸沒有產生大量的碳元素。
赫羅圖中的水平分支恆星則具備3氦過程的所需條件,可以大量生成碳。
超新星爆炸再將這些恆星內部的碳散佈到太空中,這些含碳的塵埃聚合形成第二代、第三代恆星及其行星。
太陽系屬於第三代恆星系統,因此地球生物所賴以為生的碳元素,最初也是在巨大恆星的內部合成的。
有機化合物
碳循環與有機化合物形成的關係。植物進行光合作用時,二氧化碳和水會形成有機化合物,再被其他動植物所用。
碳能夠形成串連的C-C鍵,形成很長的分子鏈,這種特性叫做成鏈。
碳-碳鍵強而穩定。因此,碳可以形成幾乎無限種不同的化合物。 其實,碳化合物的數量比其他所有元素的化合物加起來還要多。
最簡單的有機分子是碳氫化合物。
這些化合物以一條碳鏈為主幹,並有氫原子鍵合在碳鏈上。
鏈長、支鏈及官能團等都會影響有機化合物的物理及化學特性。所有生物體中都含有碳,並以碳作為有機化學的基礎。
碳氫化合物在工業上可用作製冷劑、潤滑劑、溶劑、塑料的製造原料、化石燃料等等。
碳與氧和氫結合後,會形成眾多必不可少的生物化合物,包括糖、木酯素、甲殼素、醇、脂、酯、類胡蘿蔔素、萜烯等等。
碳與氮結合會形成生物鹼,再加上硫後會形成抗生素、胺基酸及橡膠等等。
最後加入磷,會形成生命所需的化學編碼分子DNA及RNA,以及生物細胞用以傳遞能量的三磷酸腺苷(ATP)。
無機化合物
這些無機化合物包括最簡單的各種氧化碳,其中最重要的就是二氧化碳(CO2)。
二氧化碳曾是古大氣層的主要成份,但今天則只佔地球大氣層中的極小一部分。
當二氧化碳溶於水後,會形成碳酸(H
然而通過這一中繼狀態,因共振而穩定的碳酸鹽離子得以形成。 一些重要的岩石都含有碳酸鹽,如石灰岩、白堊岩和大理石等。
另一常見的碳氧化物是一氧化碳(CO),一種在不完全燃燒後產生的無色、無味的氣體。
一氧化碳分子中有一個三鍵,而且極性非常強,所以會不可逆轉地與血紅蛋白分子結合,
使得親和力較低的氧無法經血紅蛋白傳輸。
氰化物(CN–)的結構相似,但其特性更類似於鹵素離子(擬鹵素)。例如,氰分子((CN)2)與雙原子鹵素相似。
其他較罕見的氧化物包括二氧化三碳(C3O2)、不穩定的一氧化二碳(C2O)、
三氧化碳(CO3)環戊五酮(C5O5)、環己六酮(C6O6)和苯
當碳遇到如鎢等活性較強的金屬時,會形成碳化物(C4–)或乙炔化物(C2−2),大大提高這些合金的熔點。
碳的電負性為2.5,所以會主要形成共價鍵。碳有幾種共價鍵晶格化合物,如結構與鑽石相近的碳化矽(SiC)。
安全
純碳對人類的毒性很低,甚至可以以石墨或木炭的形式直接安全進食。
碳可以抵抗化學侵蝕,包括消化道中的酸。
因此當進入人體組織後,碳會長時間存留。
炭黑有可能是第一種被用作紋身的顔料。冰人奧茨的身上有碳刺青,一直保留到他死後5200年後的今天。
然而,大量吸入煤灰或煤煙卻會刺激肺部,並造成煤工塵肺等阻塞性肺病。
作磨料用的鑽石粉末在進食或吸入後同樣會造成危險。柴油引擎排煙中含有碳微粒,這些微粒會在肺部積聚。
如果進入身體的含碳物質還有其他的雜質,如有機化合物和重金屬等,就有可能會對身體造成額外的傷害。
碳對大部分地球生物來說毒性都很低,但對某些生物卻有毒。比如,碳奈米微塵對果蠅屬是有毒的。
碳在高溫下能在空氣中劇烈燃燒,如溫斯喬火災就是因加熱的石墨造成的。
大量煤炭在無氧狀態下經過數億年後,首次被挖出時,可能會在接觸到空氣後自燃。
碳的眾多化合物中,有著多種劇毒,如河豚毒素、蓖麻毒蛋白、氰化物(CN−)和一氧化碳。
參考資料:維基百科
10月14日完稿