 氦(Helium),為稀有氣體的一種。
氦(Helium),為稀有氣體的一種。
氦
 氦(Helium),為稀有氣體的一種。
氦(Helium),為稀有氣體的一種。
元素名來源於希臘文,原意是“太陽”。
1868年法國的楊森利用分光鏡觀察太陽表面,
發現一條新的黃色譜線,
並認為是屬於太陽上的某個未知元素,故名氦。
氦在通常情況下為無色、無味的氣體,
是唯一不能在標準大氣壓下固化的物質。
氦是最不活潑的元素。
氦的應用主要是作為保護氣體、氣冷式核反應爐的工作流體和超低溫冷凍劑。
研究歷史
看見有彩色的彩條,是太陽噴射出來的熾熱的光譜。
他發現一條黃色譜線,接近鈉光譜總的D1和D2線。
日蝕後,他同樣在太陽光譜中觀察到這條黃線,稱為D3線。
1868年10月20日,英國天文學家洛克耶也發現了這樣的一條黃線。
 經過進一步研究,認識到是一條不屬於任何已知元素的新線,
經過進一步研究,認識到是一條不屬於任何已知元素的新線,
是因一種新的元素產生的,把這個新元素命名為 helium,
來自希臘文helios(太陽),元素符號定為He。
這是第一個在地球以外,在宇宙中發現的元素。
為了紀念這件事,當時鑄造一塊金質紀念牌,
一面雕刻著駕著四匹馬戰車的傳說中的太陽神阿波羅(Apollo)像,
另一面雕刻著詹森和洛克耶的頭像,下麵寫著:1868年8月18日太陽突出物分析。
在詹遜從太陽光譜中發現氦時,
英人J. N. Lockyer和E. F. Frankland認為這種物質在地球上還沒有發現,
因此定名為“氦”(英文為helium),源自希臘語意為“太陽”。
過了20多年後,拉姆賽在研究釔鈾礦時發現了一種神秘的氣體。
由於他研究了這種氣體的光譜,發現可能是詹森和洛克耶發現的那條黃線D3線。
但由於他沒有儀器測定譜線在光譜中的位置,
他只有求助於當時最優秀的光譜學家之一的倫敦物理學家克魯克斯。
克魯克斯證明了,這種氣體就是氦。這樣氦在地球上也被發現了。
在二十世紀初的幾十年裡,世界各國都在尋找氦氣資源,在當時主要是為了充飛艇。
但是到了二十一世紀,氦不僅用在飛行上,尖端科學研究,現代化工業技術,都離不開氦,而且用的常常是液態的氦,而不是氣態的氦。
液態氦把人們引到一個新的領域——低溫世界。
英國物理學家杜瓦(Dewar)在1898年首先得到了液態氫。
就在同一年,荷蘭的物理學家卡美林·奧涅斯也得到了液態氫。
液態氫的沸點是零下253℃,在這樣低的溫度下,其他各種氣體不僅變成液體,而且都變成了固體。
只有氦是最後一個不肯變成液體的氣體。
包括杜瓦和卡美林·奧涅斯在內的科學家們和決心把氦氣也變成液體。
1908年7月13日晚,荷蘭物理學家卡美林·奧涅斯(Heike Kamerlingh Onnes昂納斯)
和他的助手們在著名的萊頓實驗室取得成功,氦氣變成了液體。他第一次得到了320立方釐米的液態氦。
要得到液態氦,必須先把氦氣壓縮並且冷卻到液態空氣的溫度,然後讓它膨脹,使溫度進一步下降,氦氣就變成了液體。
液態氦是一種與眾不同的液體,其沸點為零下269℃。在這樣低的溫度下,氫也變成了固體,
與空氣接觸時,空氣會立刻在液態氦的表面上凍結成一層堅硬的蓋子。
1934年,在英國盧瑟福那裡學習的前蘇聯科學家卡比查發明了新型的液氦機,每小時可以製造4升液態氦。
以後,液態氦才在各國的實驗室中得到廣泛的研究和應用。
2含量分佈
氦存在於整個宇宙中,按品質計占23%,僅次於氫。但在自然界中主要存在於天然氣體或放射性礦石中。
在地球的大氣層中,氦的濃度十分低,只有5.2萬分之一。
在地球上的放射性礦物中所含有的氦是α衰變的產物。 氦在某些天然氣中含有在經濟上值得提取的量,
最高可以含有7%,在美國的天然氣中氦大約有1%, 在地表的空氣中每立方米含有4.6立方釐米的氦,
大約占整個體積的0.0005%,密度只有空氣的7.2分之一,是除了氫以外密度最小的氣體。
地殼中含量:0.008(ppm)
元素在太陽中的含量:230000(ppm)
元素在海水中的含量:0.000006(ppm)
地球上的氦主要是放射性元素衰變的產物,α粒子就是氦的原子核。
在工業中可由含氦達7%的天然氣中提取。也可由液態空氣中用分餾法從氦氖混合氣體中制得。
3物理性質
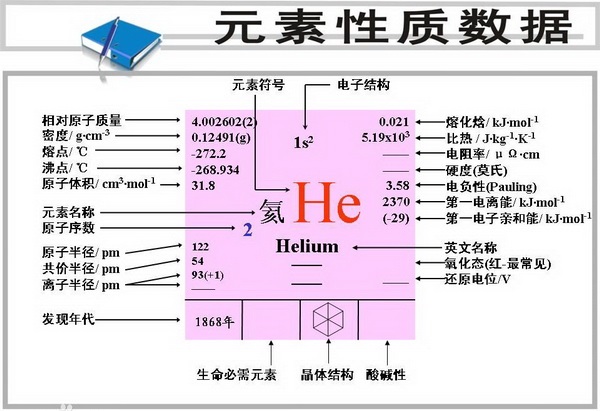
元素符號He,原子序數2,原子量4.002602(氦4),為稀有氣體的一種。元素名來源於希臘文,原意是“太陽”。
氦有兩種天然同位素:氦3、氦4,自然界中存在的氦基本上是氦4。相對原子品質為4.003。
 氦在通常情況下為無色、無味的氣體;
氦在通常情況下為無色、無味的氣體;
熔點-272.2°C(25個大氣壓),沸點-268.9°C;
密度0.1785克/升,臨界溫度-267.8°C,
臨界壓力2.26大氣壓;水中溶解度8.61釐米3/千克水。
氦是惰性元素之一,分子式為He,
是一種稀有氣體,無色、無臭、無味。
它在水中的溶解度是已知氣體中最小的,
也是除氫氣以外密度最小的氣體。
它是最難液化的一種氣體,
其臨界溫度為-267.9℃。臨界壓力為2.25大氣壓。
當液化後溫度降到-270.98℃以下時,
具有表面張力很小,導熱性很強,幾乎不呈現任何粘滯性。
液體氦可以用來得到接近絕對零度(-273.15℃)的低溫。
化學性質十分不活潑,既不能燃燒,也不能助燃。
氦也是最難液化的氣體。
氦在通常情況下為無色、無味的氣體。是唯一不能在標準大氣壓下固化的物質。
液態氦在溫度下降至2.18K時,性質發生突變,成為一種超流體,能沿容器壁向上流動,熱傳導性為銅的800倍,並變成超導體;
其比熱容、表面張力、壓縮性都是反常的。
由於液氦的超低溫,在此溫度下出現了許多奇妙的物理現象。許多重要的物理實驗,都要在低溫下進行。
世界各國的物理學家都在研究液態氦,希望通過液態氦達到更低的溫度,研究各種物質在低溫下會發生什麼變化,
會有什麼我們還不知道的性質。這就產生了物理學的一個新的分支——低溫物理學。
 氦-3
氦-3
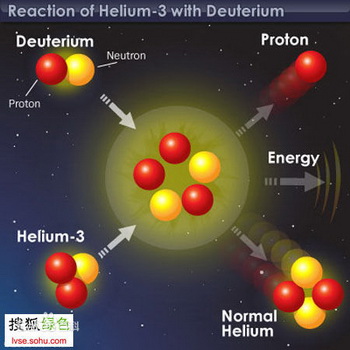
氦3是自然界中氦的穩定同位素,原子量為3.016,
原子核由2個質子和一個中子組成。
通常情況下,氦3為無色、無味、無毒、不燃燒的惰性氣體,
在
超流動性
卡美林·奧涅斯是第一個得到液氦的科學家。
他又將溫度進一步降低,試圖得到固態氦,卻並沒有成功
(固態氦是1926年基索姆用降低溫度和增大壓力的方法首先得到的)。
對於一般液體來說,隨著溫度降低,密度會逐漸增加。
卡美林·奧涅斯使液態氦的溫度下降,液氦的密度增大了。
但是,當溫度下降到零下271℃的時候,液態氦突然停止起泡,同時密度也突然減小了。
這是另一種液態氦。卡美林·奧涅斯把前一種冒泡的液態氦叫做氦Ⅰ,而把後一種靜止的液態氦叫做氦Ⅱ。
把一個小玻璃杯按在氦Ⅱ中。玻璃杯由空的漸漸裝滿了。
把這個盛著液態氦的小玻璃杯提出來,掛在半空時,玻璃杯底下出現了液氦,不一會,杯中的液態氦就“漏”光了。
氦Ⅱ能夠倒流,它會沿著玻璃杯的壁向高處倒流。
此現象只能在低溫狀態下才會發生,名為“超流動性”,具有“超流動性”的氦Ⅱ叫做超流體。
後來,許多科學家研究了這種怪現象,又有了許多新的發現。
比如1938年阿蘭等人發現的氦刀噴泉。在一根玻璃管裡,裝著很細的金剛砂,上端接出來一根細的噴嘴。
將這玻璃管浸到氦Ⅱ中,用光照玻璃管粗的下部,細噴嘴就會噴出氦Ⅱ的噴泉,光越強噴得越高,可以高達數釐米。
氦Ⅱ噴泉也是超流體的特殊性質。在這個實驗中,光能直接變成了機械能。
超導現象
在液氦的溫度下,在一個鉛環上放置一個鉛球。鉛球會好像失重而飄浮在環上,與環保持一定距離。
在同樣的溫度下,用細鏈子系著磁鐵,慢慢放到一個金屬盤子裡去。
當磁鐵快要碰到盤子的時候,可以觀察到,鏈子松了,磁鐵浮在盤子上,若此時輕輕拍打磁鐵,它會自行旋轉。
這種現象只能在低溫觀察到,高溫下不會產生。
這是低溫下的超導現象。有些金屬在液態氦的溫度下,原子核的運動幾乎停止,對電子的阻礙變得極小,
因此電阻會消失,成為超導體;由於磁力線不可能穿過超導體 ,於是在超導體與磁體中間形成了較大的磁場,
磁場的斥力托住了鉛球和磁鐵,使它們浮在半空中。
這就是邁斯納效應(Meissner Effect),這一效應可以被利用來製造磁懸浮列車。
 4化學性質
4化學性質
週邊電子排布:1s2 核外電子排布:2
氧化數:He(0)
元素類型:非金屬
氦是所有元素中最不活潑的元素,
不形成化合物(即使有,也僅痕量發現於質譜中,且不穩定),
這是因為氦的原子核到電子層距離很小,
並且達到了穩定結構。
它的性質便決定了用途,
氦的應用主要是作為保護氣體、
氣冷式核反應爐的工作流體和超低溫冷凍劑等等。
5同位素
已知的氦同位素有八種,包括氦3、氦4、氦5、氦6、氦8等,但只有氦3和氦4是穩定的,其餘的均帶有放射性。
在自然界中,氦同位素中以氦4占最多,多是從其他放射性物質的α衰變,放出氦4原子核而來。
而在地球上,氦3的含量極少,它們均是由超重氫(氚)的β衰變所產生。
氦-2:它的原子核只有2個質子,到目前為止只是假想粒子,但如果強核力增強2%,它就有可能存在。
氦-5,是氦的同位素之一,元素符號為He。它的原子核由二顆質子和三顆中子所組成。
並帶有放射性,會放出中子,其半衰期為0.6 MeV。
氦-6:原子核包含2個質子和4個中子,非常不穩定。
氦-7:原子核包含2個質子和5個中子,會衰變成氦-6,非常不穩定。
氦-8:原子核包含2個質子和6個中子,非常不穩定。
氦-9:原子核包含2個質子和7個中子,非常不穩定。
氦-10:原子核包含2個質子和8個中子,非常不穩定。
6制取方法
天然氣分離法:工業上,主要以含有氦的天然氣為原料,反復進行液化分餾,然後利用活性炭進行吸附提純,得到純氦。
合成氨法:在合成氨中,從尾氣經分離提純可得氦。
空氣分餾法:從液態空氣中用分餾法從氖氦混合氣中提出。
鈾礦石法:將含氦的鈾礦石經過焙燒,分離出氣體,再經過化學方法,除去水蒸氣、氫氣和二氧化碳等雜質提純出氦。
7作用用途
由於氦很輕,而且不易燃,因此它可用於填充飛艇、氣球、溫度計、電子管、潛水服等。
也可用於原子反應堆和加速器、雷射器、火箭、冶煉和焊接時的保護氣體,還可用來填充燈泡和霓虹燈管,也用來製造泡沫塑料。
由於氦在血液中的溶解度很低,因此可以加到氧氣中防止減壓病,作為潛水夫的呼吸用氣體,或用於治療氣喘和窒息。
液體氦的溫度(-268.93 °C)接近絕對零度(-273℃),因此它在超導研究中用作超流體,製造超導材料。
液態氦還常用做冷卻劑和製冷劑。在醫學中,用於氬氦刀以治療癌症。它還可以用作人造大氣層和鐳射媒體的組成部分。
8危險性
引起窒息
如果大量吸入氦氣,會造成體內氧氣被氦取代,
因而發生缺氧(呼吸反射是受體內過量二氧化碳驅動,而對缺氧並不敏感),嚴重的甚至會死亡。
另外,如果是由高壓氣瓶中直接吸入氦氣,那麼其高流速就會嚴重地破壞肺部組織。
大量而高壓的氦和氧會造成高壓緊張症狀High
pressure nervous syndrome (HPNS),不過少量的氮就能夠處理這個問題。
而空氣中百分之七十八都是氮氣,所以不用擔心。據介紹,大量及長時間吸入氦氣可導致腦損傷甚至死亡。
在大部分薯條類包裝袋裡也含有少量氦氣,不過不必擔心,沒有危害。