 氟是一種非金屬化學元素,
氟是一種非金屬化學元素,
氟
 氟是一種非金屬化學元素,
氟是一種非金屬化學元素,
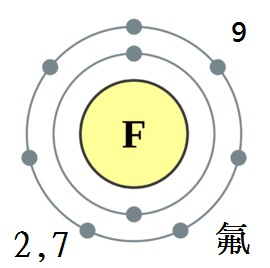
化學符號F,原子序數9。
氟是鹵族元素之一,屬週期系ⅦA族,
在元素週期表中位於第二週期。
氟元素的單質是F2,它是一種淡黃色,劇毒的氣體。
氟氣的腐蝕性很強,化學性質極為活潑,
是氧化性最強的物質之一,甚至可以和部分惰性氣體在一定條件下反應。
氟是特種塑膠、橡膠和冷凍機(氟氯烷)中的關鍵元素。
由於氟的特殊化學性質,氟化學在化學發展史上有重要的地位。
物理性質
氟在標準狀態下是淡黃色氣體,液化時為黃色液體。在
由於氟的特殊化學性質,導致其物理性質的測定的難度較大,一些資料的準確性並不是很高,
下面的資料採用了參考資料中的最新資料或時間相近資料中有效數字位元數較多者。
化學性質
電子層排布:[He]2s2 2p5;氟是已知元素中非金屬性最強的元素,這使得其沒有正氧化態。
氟的基態原子價電子層結構為[He]2s2 2p5,且氟具有極小的原子半徑,因此具有強烈的得電子傾向,
具有強的氧化性,是已知的最強的氧化劑之一。氟的鹵素互化物有ClF、ClF3、BrF3、IF6等。
與單質的反應
氫與氟的化合反應異常劇烈,即使在
不但是氫氣,氟可以與除O,N,He與Ne以外所有元素的單質反應,生成最高價氟化物。
除具有最高價態的金屬氟化物和少數純的全氟有機化合物外,幾乎所有化合物均可以與氟反應。
即使是全氟有機化合物,如果被可燃物污染,也可以在氟氣中燃燒。
大多數有機化合物與氟的反應將會發生爆炸,碳或大多數烴與過量氟的反應,將生成四氟化碳及少量四氟乙烯或六氟丙烷。
由於氟強烈的氧化性,氟甚至可以和氙直接化和。由於反應條件的不同,產物可以是XeF2,XeF4,XeF6。
通常,由於氮對氟而言是惰性的,可用作氣相反應的稀釋氣。
氮和氟用輝光放電法可以化合為NF3。
氟在與銅、鎳或鎂反應時,金屬表面會形成緻密的氟化物保護膜以阻止反應,因此氟氣可保存在這些材料製成的容器中。

與化合物的反應
氟氣與水的反應複雜,主反應為:生成氟化氫和氧,副反應生成少量的過氧化氫、二氟化氧和臭氧。
氟與氨氣的反應為:但若氨氣過量,除了生成NF3,還會生成N
氟與一氧化氮反應,生成氟化亞硝醯:氟與無水亞硝酸鈉在加熱條件下,
或是令二氧化氮在氟中燃燒,可以得到氟化硝醯。氟與稀釋的疊氮化氫反應,生成疊氮氟化物。
一般情況下,氧與氟不反應,但存在兩種已知的氧氟化物,即OF2和O
在2%的氫氧化鈉溶液中通入氟,可以得到OF2:氟氣通過冰水的表面,可以制得次氟酸(HOF)。
通常氟與有機物反應會因過於劇烈而只能得到簡單有機氟化物,
但如果將氟稀釋一定比例,也可以發生類似氯和溴的有機加成反應或是有機取代反應。
二氧化矽在氟氣中可燃燒,生成氧:氟還可以從許多含鹵素的化合物中取代其他鹵素。(X為其他鹵素)。
F的一些特殊性質可以從以下幾個方面進行解釋:F的電負性最大;標準電極電勢
F2/F-最大;
F的原子半徑小,因此氟分子中孤對電子的排斥力相當大,並且氟無可利用的d軌道,
因此不能形成d-pπ鍵,使得F-F鍵鍵能非常小;氟化物中,氟與其他元素形成的化學鍵非常強,
離子型的鹵化物中,一般氟化物晶格能U最大;共價型鹵化物中,一般氟化物△fGm最負。
其他
一些含氟化合物具有極強的路易士酸性,例如BF3,SbF5等,將SbF5溶於液態氟化氫,可以得到氟銻酸,這是一種超強酸。
研究歷史
1774年瑞典化學家舍勒在研究硫酸與螢石的反應時發現HF,並於1789年提出它的酸根與鹽酸酸根性質相似的猜想。
而後法國化學家蓋·呂薩克等繼續進行提純氫氟酸的研究,到了1819年無水氫氟酸雖然仍未分離,
但其對玻璃以及矽酸鹽反應的本質已被闡明:CaSiO₃
+ 6 HF →
CaF₂
+ SiF₄
+ 3H₂O;
SiO₂
+ 4 HF →
SiF₄
+ 2H₂O
19世紀初期安培給大衛的信函中指出氫氟酸中存在著一種未知的化學元素,正如鹽酸中含有氯元素,
並建議把它命名為“Fluor”,詞源來自拉丁文及法文,
原意為“流動 (flow, fluere)”之意。
在此之後,1813年大衛,1836年喬治·諾克斯及托馬士·諾克斯,1850年弗累密,
1869年哥爾,都曾嘗試製備出氟單質,但最終都因條件不夠或無法分離而失敗,他們因長期接觸含氟化合物中毒而健康受損。
1886年的6月弗累密的學生莫瓦桑總結前人分離氟元素失敗的原因,並以他們的實驗方案作為基礎,
剛開始曾選用低熔點的三氟化磷及三氟化砷進行電解,陽極上有少量氣泡冒出,
但仍腐蝕鉑電極,而大部分氣泡仍未升上液面時被液態氟化砷吸收而失敗。
1886年莫瓦桑採用液態氟化氫作電解質,在其中加入氟氫化鉀(KHF₂)
使它成為導電體;
以鉑制U形管盛載電解液,鉑銥合金作電極材料,螢石製作管口旋塞,接合處以蟲膠封固,
電降槽(鉑制U形管)以氯乙烷(C₂H₅Cl)作冷凝劑,實驗進行時,電解槽溫度降至
被富集的氣體呈黃綠色,氟元素被成功分離。莫氏發現氟的成就,使他獲得卡柴獎金(Prix
1896年獲英國皇家科學會贈大衛獎章;1903年德國化學會贈他霍夫曼獎章; 1906年獲諾貝爾化學獎。
他因長期接觸一氧化碳及含氟的劇毒氣體,健康狀況較常人先衰,
主要用途
利用氟的強氧化性,可以制取UF6(g)。利用238UF6與235UF6擴散速率的不同,來分離出鈾的同位素;
用於合成氟利昂等冷卻劑;用於制氟化試劑(二氟化氙等)以及金屬冶煉中的助熔劑(冰晶石等)等;
ClF3與BrF3可作火箭燃料的氧化劑;用於制殺蟲劑與滅火劑;氟代烴可用于血液的臨時代用品;
氟化物玻璃(含有ZrF4、BaF2、NaF)的透明度比傳統氧化物玻璃大百倍,即使在強輻射下也不變暗;
氟化物玻璃纖維製成的光導纖維,效果比SiO2的光導纖維效果大百倍;
含氟塑料和含氟橡膠有特別優良的性能,用於氟氧吹管和製造各種氟化物;
氟元素也添加于牙膏中作為含氟牙膏,氟化鈉與牙齒中的堿式磷酸鈣反應生成更堅硬和溶解度更小的氟磷酸鈣。
元素分佈
自然界
氟是自然界中廣泛分佈的元素之一。氟在地殼的存量為6.5×10-2%,存在量的排序數為13。
自然界中氟主要以螢石(CaF2),冰晶石(Na3[AlF6])及以氟磷灰石(Ca10(PO4)
人體分佈
氟元素在正常成年人體中約含
在這兩者中積存了約90%的氟,血液中每毫升含有0.04微克∼0.4微克。
人體所需的氟主要來自飲用水。人體每日攝入量
同位素
氟在自然界中大量存在的同位素僅有
目前臨床最常用的示蹤劑——氟-18代去氧葡萄糖(
製備方法
與氟處於同一族的氯通常使用電解法氯化鈉法制取,然而,由於氟離子的還原性極弱,
使得氟單質不能通過電解氟化物水溶液的方式獲得。
工業上使用電解液態氟化氫的方法制取氟單質,其基本原理是:
由於無水氟化氫導電性能不佳,會將其中加入氟化鉀以增強其導電性,並在電解過程中不斷加入HF以保持其液態。
實驗室通常利用一些不穩定的氟化物來制取氟單質:例如六氟合鉛酸鈉是一種不穩定、易分解的氟化物,加熱生成四氟合鉛酸鈉和氟氣。
此外四氟化錳在熱力學上也不穩定,但其鹽[MnF6]能穩定存在,於是用強路易士酸五氟化銻將其從[MnF6]中取代出來,便得到氟單質:
氟化合物的安全
氟化合物對人體有害,少量的氟(
因吸入量不同,可以產生各種病症,例如厭食、噁心、腹痛、胃潰瘍、抽筋出血甚至死亡。
若中毒量不足致死,人體可以迅速從氟中毒中恢復,尤其在使用靜脈注射或是肌肉注射葡萄糖酸鈣治療時,
約有90%的氟可被迅速消除,剩餘的氟則需要時間除去。
經常接觸氟化物,容易導致骨骼變硬、脆化,牙齒脆裂斷落等症狀,部分地區飲水中含氟量過大也容易導致氟中毒。
痕量的氟有利於預防齲齒,若水中的氟含量小於0.5ppm,齲齒的病發率會達到70%~90%。
但如果飲用水中含氟量超過1ppm,牙齒則會逐漸產生斑點並變脆。
飲用水中氟含量超過4ppm時,人易患氟骨病,導致骨髓畸形。降低飲用水中氟含量的方法是煮沸飲用水。
不溶性的氟化物毒性低,對皮膚無刺激,但若吸入大量粉塵,則容易被人體吸收而慢性中毒。
可溶性的氟化物被吸收後可迅速排出,一次吞服5~
酸性氟化物,例如氫氟酸,氟硼酸等會劇烈腐蝕皮膚,接觸處會發生紅腫並蔓延,產生難以癒合的潰瘍。
單質氟、氟化氫等氣體對人眼、鼻有刺激,吸入量過大則會引起嚴重的氣管炎和肺水腫,導致死亡。
接觸氟化物工作的人最嚴重和最危險的是臉部和皮膚接觸氟和氟化物。
因此在使用氟和氟化物時必須遵守操作流程,並有可靠的安全措施,包括操作用具、橡皮手套,
有遮蓋的防護面罩和有防酸性氣體的防毒面具。工作場所應有良好的通風設施,對於反應活性大的物品應有防爆裝置。
被氟化氫與其他氟化物灼傷時要及時處理灼傷部位先用大量水沖洗,再用甘油氧化鎂塗敷,
最妥善的方法是立即在患處注射葡萄糖酸鈣,使氟被固定為不溶性的氟化物。
此外使用六氟靈沖洗是處理氫氟酸事故的良好方法,
六氟靈的原理是通過中和反應和配位作用減少人體內的氫離子與氟離子數量。
一部分有機氟化物的毒性很大,其中對於含氟羧酸,
結構通式為F(CH2)nCOOH,若n為奇數則該有機物是極毒的,n為偶數時毒性很小甚至無毒。
在2013年11月底發生過快遞運送氟乙酸甲酯而致人死亡的事件,其中氟乙酸甲酯的氟乙酸部分n=1。
氟對於昆蟲的毒性近似於氟化氫,對於植物的毒性則近似二氧化硫,氟化合物會使得植物葉端和葉脈出現白斑或者褐斑。