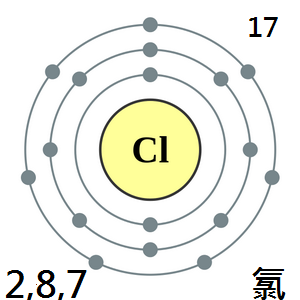
氯

氯是一種非金屬元素,屬於鹵族之一。
氯氣常溫常壓下為黃綠色氣體,
化學性質十分活潑,具有毒性。
氯以化合態的形式廣泛存在於自然界當中,
對人體的生理活動也有重要意義。
發現簡史
 1774年,瑞典化學家舍勒在從事軟錳礦的研究時發現:
1774年,瑞典化學家舍勒在從事軟錳礦的研究時發現:
軟錳礦與鹽酸混合後加熱就會生成一種令人窒息的黃綠色氣體。
當時,大化學家拉瓦錫認為氧是酸性的起源,一切酸中都含有氧。
舍勒及許多化學家都堅信拉瓦錫的觀點, 認為這種黃綠色的氣體是一種化合物,
是由氧和另外一種未知的基所組成的, 所以舍勒稱它為“氧化鹽酸”。
但英國化學家大衛卻持有不同的觀點,
他想盡了一切辦法也不能從氧化鹽酸中把氧奪取出來,均告失敗。
他懷疑氧化鹽酸中根本就沒有氧存在。
1810年,大衛以無可辯駁的事實證明了所謂的氧化鹽酸不是一種化合物,而是一種化學元素的單質。
他將這種元素命名為“Chlorine”。
它的希臘文原意是“綠色”。中文譯名為氯。
 自然分佈
自然分佈
自然界中游離狀態的氯存在於大氣層中,
是破壞臭氧層的主要單質之一。
氯氣受紫外線分解成兩個氯原子(自由基)。
大多數通常以氯化物(Cl-)的形式存在,
常見的主要是氯化鈉(食鹽,NaCl)。
單質:Cl₂
氯單質由兩個氯原子構成,化學式為Cl2。氣態氯單質俗稱氯氣,液態氯單質俗稱液氯。
名稱由來
英文名稱chlorine來自于希臘文khlros(淡綠色),中文取該氣體為綠色之意造了“氯”字,
日文與韓文則因為氯是鹽的主要成分之一而稱為“鹽素”(日本漢字寫作“塩素”)。
化合物
無機:氯化物、次氯酸、次氯酸鹽、亞氯酸、亞氯酸鹽、氯酸、氯酸鹽、高氯酸、高氯酸鹽有機氯化合物。
同位素
氯元素有35Cl和37Cl兩種穩定同位素。核外電子構型都為 [Ne]3s23p5。
相對原子品質分別為34.968 852和36.965 903。天然豐度分別為75.77%和24.23%。
氯離子的檢驗
檢驗水中是否含有氯離子可以向其中加入硝酸酸化的銀離子(如硝酸銀)(加入酸性硝酸銀可以排除其他離子干擾),
銀離子和氯離子反應會生成氯化銀白色沉澱,反應式:(Ag+)+(Cl-) →
AgCl↓
物理性質
氯氣為黃綠色氣體,密度比空氣大(3.214g/L),熔點−101.0℃,沸點−34.4℃,有強烈的刺激性氣味。
氯氣分子由兩個氯原子組成,微溶于水,易溶於堿液,易溶於四氯化碳、二硫化碳等有機溶劑。
氯有26種同位素,其中只有35Cl和37Cl是穩定的,其餘同位素均具有放射性。
營養功能
參與光合作用
在光合作用中,氯作為錳的輔助因數參與水的光解反應。
水光解反應是光合作用最初的光化學反應,氯的作用位元點在光系統II。
研究工作表明,在缺氯條件下,植物細胞的增殖速度降低,葉面積減少,生長量明顯下降(大約60%),
但氯並不影響植物體中光合速率。
由此可見,氯對水光解放O2反應的影響不是直接作用,氯可能是錳的配合基,
有助於穩定錳離子,使之處於較高的氧化狀態。
氯不僅為希爾反應放O2所必需,它還能促進光合磷酸化作用。
調節氣孔運動
氯對氣孔的開張和關閉有調節作用。當某些植物葉片氣孔開張時,
K+流入是由有機酸陰離子(主要是蘋果酸根)作為陪伴離子,這些離子在代謝過程中是靠消耗澱粉產生的;
但是對某些澱粉含量不多的作物(如洋蔥),當K+流入保衛細胞時,由於缺少蘋果酸根則需由Cl-作為陪伴離子。
缺氯時,洋蔥的氣孔就不能自如地開關,而導致水分過多地損失。
由於氯在維持細胞膨壓、調節氣孔運動方面的明顯作用,從而能增強植物的抗旱能力。
啟動H+-泵ATP酶
以往人們瞭解較多的是原生質上的H+-ATP酶,它受K+的啟動。
而在液泡膜上也存在有H+-ATP酶。
與原生質上的H+-ATP酶不同,這種酶不受一價陽離子的影響,而專靠氯化物啟動。
該酶可以把原生質中的H+轉運到液泡內,使液泡膜內外產生pH梯度(胞液,pH>7;液泡,pH<<6)。
缺氯時,植物根的伸長嚴重受阻,這可能和氯的上述功能有關。
因為缺氯時,影響活性溶質滲入液泡內,從而使根的伸長受到抑制(Hagerh和Helrnle,1981)。
抑制病害發生
施用含氯肥料對抑制病害的發生有明顯作用。
據報導,2013以前年至少有10種作物的15個品種,其葉、根病害可通過增施含氯肥料而明顯減輕。
例如冬小麥的全蝕病、條銹病,春小麥的葉銹病、枯斑病,
大麥的根腐病,玉米的莖枯病,馬鈴薯的空心病、褐心病等。
根據研究者的推論,氯能抑制土壤中銨態氮的硝化作用。
當施入銨態氮肥時,氯使大多數銨態氮不能被轉化,而迫使作物吸收更多的銨態氮;
在作物吸收銨態氮肥的同時,根系釋放出H+離子,使根際酸度增加。
許多土壤微生物由於適宜在酸度較大的環境中大量繁衍,從而抑制了病菌的滋生,
如小麥因施用含氯肥料而減輕了全蝕病病害的發生。
還有一些研究者從C1-和NO3-存在吸收上的競爭性來解釋。
施含氯肥料可降低作物體內NO3-的濃度,一般認為NO3-含量低的作物很少發生嚴重的根腐病。

其他作用
在許多陰離子中,Cl-是生物化學性質最穩定的離子,
它能與陽離子保持電荷平衡,維持細胞內的滲透壓。
植物體內氯的流動性很強,輸送速度較快,
能迅速進入細胞內,提高細胞的滲透壓和膨壓。
滲透壓的提高可增強細胞吸水,
並提高植物細胞和組織束縛水分的能力。
這就有利於促進植物從外界吸收更多的水分。
在乾旱條件下,也能減少植物丟失水分。
提高膨壓後可使葉片直立,延長功能期。 作物缺氯時,葉片往往失去膨壓而萎蔫。
氯對細胞液緩衝體系也有一定的影響。
氯在離子平衡方面的作用,可能有特殊的意義。
氯對酶活性也有影響。氯化物能啟動利用穀氨醯胺為底物的天冬醯胺合成酶,促進天冬醯胺和谷氨酸的合成。
氯在氮素代謝過程中有重要作用。
適量的氯有利於碳水化合物的合成和轉化。
化學性質
氯原子的最外電子層有7個電子,在化學反應中容易結合一個電子,使最外電子層達到8個電子的穩定狀態,
因此氯氣具有強氧化性,能與大多數金屬和非金屬發生化合反應。
氯氣遇水歧化為鹽酸和次氯酸,次氯酸不穩定易分解放出游離氧,所以氯氣具有漂白性(比SO2強且加熱不恢復原色)。
氯氣也能和很多有機物發生加成或取代反應,在生活中有廣泛應用。氯氣具有較大的毒性,曾被用作軍用毒氣。
檢驗水中是否含有氯離子可以向其中加入可溶的銀離子(硝酸銀)(加入酸性硝酸銀可以排除其他離子干擾),
銀離子和氯離子反應會生成氯化銀白色沉澱。再取白色沉澱,加入稀硝酸,沉澱不溶解,則說明含氯離子。
含氧酸
1.
次氯酸(HClO)及其鹽
(1)
製備
①通氯氣于冰水中:Cl₂
+ H₂O
= HClO + HCl
②通氯於堿液中可得次氯酸鹽:Cl₂+
2NaOH
→ NaClO + NaCl + H₂O
③工業上用電解冷濃食鹽水並劇烈攪拌來製備NaClO
(2)性質
①是弱酸,但為很強的氧化劑,且具有漂白性
②受熱易發生氧化還原反應 3ClO-→ ClO₃-
+ 2Cl-
(3)
用途
1.製造漂白粉Ca(ClO)₂
漂白粉:Cl₂與Ca(OH)₂反應
2Cl₂
+ 2Ca(OH)₂
= Ca(ClO)₂+
+CaCl₂
+2H₂O
2.
亞氯酸(HClO₂)及其鹽
亞氯酸是唯一的亞鹵酸,非常不穩定。
(1)
製備
①ClO₂在水中分解:2ClO₂
+ H₂O
= HClO₂
+ HClO₃
②通ClO₂於Na₂O₂或NaOH與H₂O₂可得亞氯酸鹽
2ClO₂
+ Na₂O₂
=2NaClO₂
+ O₂;2ClO₂
+ H₂O₂
+ OH 2ClO= 2-
+O₂
+ H₂O
(2)
性質與用途
①非常不穩定的化合物,但亞氯酸鹽較穩定。
②具有漂白性
3.
氯酸(HClO₃)及其鹽,濃度高於40%則不穩定
(1)
製備
①次氯酸根水溶液加熱,產生自身氧化還原反應(歧化反應):3ClO-→
ClO₃-
+ 2Cl-
②電解熱氯化鈉水溶液並加以攪拌:3Cl₂
+ 6OH-
→ ClO₃-
+ 5Cl- + 3H₂O
(2)
性質及用途
①氯酸和氯酸鹽皆為強氧化劑
②氯酸鉀用於製造炸藥
③KClO₃受熱反應
A.無催化劑,微熱:4KClO₃
=3KClO₄
+ KCl (約100℃)
B.催化劑(MnO₂):2KClO₃
=2KCl + 3O₂↑
(約300℃)
4.
高氯酸(HClO₄)及其鹽
(1)
製備
①低壓蒸餾KClO₄與H₂SO₄的混合液:KClO₄
+ H₂SO₄
= HClO₄
+ KHSO₄
②電解食鹽水時,陽極產生的氯氣被氧化:1/2Cl₂
+ 4H₂O
=ClO₄-+
8H+ + 7e-
③氯酸鹽受熱分解:4KClO₃
= 3KClO₄
+ KCl
性質與用途
①氯最穩定的含氧酸,不易分解
②非常強的酸(高中範圍內最強的酸,強於100%硫酸,但弱於氟銻酸等超強酸)[1]
工業制法
通常用電解飽和食鹽水來制取,電解飽和食鹽水時,陰極出氫(放有鐵絲):
2H₂O+2e-=H₂↑+2OH-,陽極出氯(放有石墨):2Cl-=Cl₂+2e-。
化學方程式為:2NaCl+2H₂O=2NaOH+H₂↑+Cl₂↑。(條件:通電。)
實驗室制法
反應原理:在酸性條件下,用氧化劑氧化-1價的氯的化合物制得。
實驗室中可以用濃鹽酸和二氧化錳共熱來制取,也可以用濃鹽酸和高錳酸鉀反應來制取。
反應方程式:MnO₂+4HCl=MnCl₂+Cl₂↑+2H₂O。(條件:加熱。)或2KMnO₄+16HCl=2MnCl₂+2KCl+5Cl₂↑+8H₂O。
主要用途
工業
氯主要用於化學工業尤其是有機合成工業上,以生產塑膠、合成橡膠、染料及其他化學製品或中間體,
還用於漂白劑、消毒劑、合成藥物等。氯氣亦用作製造漂白粉、漂白紙漿和布匹、合成鹽酸、製造氯化物、
飲水消毒、合成塑膠和農藥等。提煉稀有金屬等方面也需要許多氯氣。
生理
氯是人體必需常量元素之一,是維持體液和電解質平衡中所必需的,也是胃液的一種必需成分。
自然界中常以氯化物形式存在,最普通形式是食鹽。
氯在人體含量平均為1.17g/kg,總量約為82~100g,占體重的0.15%,廣泛分佈於全身。
主要一氯離子形式與鈉、鉀化合存在。
其中氯化鉀主要在細胞內液,而氯化鈉主要在細胞外液中。
膳食氯幾乎完全來源於氯化鈉,僅少量來自氯化鉀。因此食鹽及其加工食品醬油、醃制肉或煙熏食品、
醬菜類以及鹹味食品等都富含氯化物。一般天然食品中氯的含量差異較大;天然水中也幾乎都含有氯。
主要生理功能:
1.維持體液酸堿平衡。
2.氯離子與鈉離子是細胞外液中維持滲透壓的主要離子,二者約占總離子數的80%左右,
調節與控制著細胞外液的容量和滲透壓。
3.參與血液CO二價離子運輸。
4.氯離子還參與胃液中胃酸形成,胃酸促進維生素B12和鐵的吸收;啟動唾液澱粉酶分解澱粉,促進食物消化;
刺激肝臟功能,促使肝中代謝廢物排出;氯還有穩定神經細胞膜電位的作用等。