 溴(拉丁語:Bromum,源於希臘語:
溴(拉丁語:Bromum,源於希臘語:
溴(化學元素)
 溴(拉丁語:Bromum,源於希臘語:
溴(拉丁語:Bromum,源於希臘語:
意為“公山羊的惡臭”,
是一個化學元素,
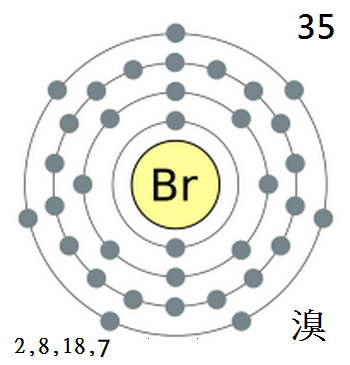
元素符號 Br,原子序數 35,
在化學元素週期表中位於第4週期、
第VIIA族,是鹵素之一。
溴分子在標準溫度和壓力下是有揮發性的紅棕色液體,
活性介於氯與碘之間。
純溴也稱溴素。
溴蒸氣具有腐蝕性,並且有毒。
溴與其化合物可被用來作為阻燃劑、淨水劑、殺蟲劑、染料等等。
曾是常用消毒藥劑的紅藥水中含有溴和汞。
在照相術中,溴和碘與銀的化合物擔任感光劑的角色。
物理性質
 溴是唯一在室溫下是液態的非金屬元素,
溴是唯一在室溫下是液態的非金屬元素,
並且是週期表上在室溫或接近室溫下為液體的六個元素之一。
溴的熔點是-7.2 °C,而沸點是 58.8 °C。
元素單質的形式是雙原子分子:Br2。
它是黏稠的,可流動的,紅棕色的液體,
並在標準溫度和壓力下容易揮發,
形成紅色的蒸氣
(顏色近似於二氧化氮)並且有一股與氯氣相似的惡臭。
溴是一種鹵素,它的活性小於氯但大於碘。
溴微溶于水,但對二硫化碳,
有機醇類(像甲醇)與有機酸的溶解度佳。
它很容易與其他原子鍵結並有強烈的漂白作用。
溴像氯一樣,也有用在游泳池的維護。
一些特定的溴化合物被認為是有可能破壞臭氧層的或是具有生物累積性的。
所以許多工業用的溴化合物不再被生產,被限制,或逐漸的淘汰。
蒙特利爾公約提到了一些有機溴化物是需要被逐漸淘汰的。
溴是一種強氧化劑。它會和金屬和大部分有機化合物產生激烈的反應,若有水參與則反應更加劇烈,
溴和金屬反應會產生金屬溴鹽及次溴酸鹽(有水參與時),和有機化合物則可能產生磷光或螢光化合物。
性狀:深紅棕色發煙揮發性液體。有刺激性氣味,其煙霧能強烈地刺激眼睛和呼吸道。
在空氣中迅速揮發。易溶於乙醇、乙醚、氯仿、二硫化碳、四氯化碳、濃鹽酸和溴化物水溶液,微溶于水。
對大多數金屬和有機物組織均有侵蝕作用,甚至包括鉑和鈀。
與鋁、鉀等作用發生燃燒和爆炸。它是ⅦA族(鹵族元素)的第三號元素。
 化學性質
化學性質
溴最外層電子為4s2 4p5,
有很強的的電子傾向,因此具有較強的氧化性。
而溴的4d軌道是全空的,
可以接受電子,
因此也表現出一定的還原性。
溴單質能與大部分單質化合,
部分需要加熱或其它條件。
氫與溴在含鉑的石棉或矽膠催化下,
加熱至200~400°C可以化合為溴化氫。
溴可以把磷(0)氧化為磷(III):
生成的三溴化磷為液體,
摻雜著部分五溴化磷。
溴與一氧化碳反應,可得到碳醯溴:
與氨反應,生成溴化銨與氮氣:
溴可以置換出水中的一些非金屬陰離子,例如溴與硫離子的反應:
溴與氟氣混合,可以得到三氟化溴:氟過量則生成五氟化溴:
溴在水中及堿溶液中易歧化,在水中反應為,在堿溶液中則因溫度不同而發生不同反應,
在0°C及以下的低溫中發生的反應為:,在50°C及以上的溫度主要發生的反應為:。
有機反應
Br-Br鍵鍵能相對較小,在一定條件的激發下易斷裂,根據斷裂時電子的分佈,可分為均裂與異裂。
在紫外線或250~400°C下,將溴與烷烴混合,會發生自由基取代反應,反應將烷烴上的氫取代為溴。
溴發生自由基取代反應時,3°碳,2°碳,1°碳之間的反應活性相差非常大,選擇性較好,得到的產物較為純淨。
在極性溶劑中,溴易發生異裂,生成溴離子,發生離子型反應,例如溴與烯烴的加成,便是這類反應。
3.
苯(用溴化鐵做催化劑)和溴的取代反應:用的溴是純溴,不能是水溶液。
不用催化劑反應很慢。鐵做催化劑時,不需加熱,該反應是放熱反應;
4.
乙醇可與HBr、PBr3發生取代反應;CH3COOH可與PCl3、PCl5、SOCl2等發生羥基位的取代反應,
例如CH3COOH+SOCl2→CH3COCl;CH3COOH可以在P做催化劑的條件下與鹵素發生a--鹵代反應,
例如:CH3COOH + Cl2→ClCH2COOH +HCl。
醛與溴的在堿的催化下,由於羰基的作用,醛的α-氫變得異常活潑而被溴取代,生成α-溴代醛和溴化氫。
而且往往α-氫趨向於全部被取代。例如,CH3CHO+Br2=Br-CH2-CHO+HBr
反應機理:
1.堿和α-氫結合生成碳負離子,是一個慢過程,反應速度與溴的濃度無關;
2.生成的烯醇負離子很快與Br2反應,得到α-溴代醛。
重複以上過程,可以得到二溴代醛,三溴代醛(假如是乙醛的話有三個α-氫原子)。
3.得到的a-溴代產物由於溴的強吸電子效應,使羰基碳原子正電性大大加強,
在鹼性條件下,C-C鍵容易斷裂,生成溴仿和羧酸鹽。
Br3-C-CHO+H2O=CHBr3+HCOOH(與催化劑堿中的金屬離子結合成甲酸鹽)。
在酸性條件下,溴化反應的速度與醛的濃度有關,反應的本質是溴與烯醇式C=C的親電加成。
與堿催化不同,酸催化的條件下可以使溴化反應停留在一溴代醛階段。
化合物
溴最重要的化合物,就算是溴化銀了。
溴化銀有一個奇妙的特性——對光很敏感,稍微受到光的刺激,他就會分解。
人們把它和阿拉伯數家製成乳劑塗在膠片上,就製成了“溴膠於片”。
我們平常用的照相膠捲、照相底片、印相紙,幾乎都塗有一層溴化銀。
在1962年,全世界溴的化合物的產量已近十萬噸,其中將有近九萬噸用於攝影。
人們在溴化銀中加入了許多其他物質,大大增加了膠片的品質,
已經把曝光的時間縮短到了十萬分之一秒以致百萬分之一秒,拍下正在飛行中的子彈和火箭;
人們還能在菜油燈或者火柴那樣微弱的光線下,拍出清晰的照片
發現過程
1824年,法國一所藥學專科學校的22歲青年學生波拉爾,
在研究他家鄉蒙彼利埃(Montpellier)的水提取結晶鹽後的母液,進行了許多實驗。當通入氯氣時,母液變成紅棕色。
最初,巴拉爾認為這是一種氯的碘化物溶液,希望找到這些廢棄母液的組成元素。
但他嘗試了種種辦法也沒法將這種物質分解,所以他斷定這是和氯以及碘相似的新元素。
巴拉爾把它命名為muride,來自拉丁文muria(鹽水)。
1826年8月14日法國科學院組成委員會審查巴拉爾的報告,肯定了他的實驗結果,
把muride改稱bromine,來自希臘文brōmos(惡臭),因為溴具有刺激性臭味。
實際上所有鹵素都具有類似臭味。溴的拉丁名bromium和元素符號Br由此而來。
溴分別被兩個科學家安東尼·巴拉爾(Antoine Balard) 和卡爾·羅威(Carl
Löwig)在1825年與1826年所發現。
1826年,剛剛取得藥劑師學位的年輕化學實驗室助理巴拉爾
在蒙彼利埃的鹽沼中的海苔的灰燼中發現了一種棕黃色的液體,這種液體後來被證明是溴的化合物。
那些海苔是用來製備碘的,但其中也含有溴。巴拉爾從有著飽和氯的海苔灰溶液中分離出溴。
他發現產物的性質介於氯與碘之間,因此他試著證明該化合物是一氯化碘(ICl),
但在失敗後他確信他發現了一個新元素,並把它稱之為rutile(意為紅色),
而他的導師約瑟夫·安哥拉達則建議稱之為muride,源自拉丁文字muria,意思是鹵水。
卡爾·賈古柏·羅威在1825年從巴特克羅伊茨納赫村裡的水泉中分離出了溴。
羅威用了一個有飽和氯的礦物鹽溶液,並用乙醚提取出了溴。在醚蒸發後,留下了一些棕色的液體。
他用此液體作為他工作的樣本申請了一個在裡歐波得·甘末林(Leopold Gmelin)的實驗室的職位。
由於發現的公開被延遲了,所以巴拉爾率先發表了他的結果。
在他發表的論文中,巴拉爾說他基於安格拉達的建議把新元素的名字從muride改成bromine。
其他的說法則認為法國的化學與物理學家呂薩克基於它蒸氣的獨特氣味建議了這個名稱。
溴直到1860年才被大量的製造。
在少數的藥學應用之外,溴的第一個商業應用是用於銀版攝影法。
在1840年,發現到用溴製造銀版攝影法用的光敏的鹵化銀在許多地方勝過之前所使用的碘蒸氣。
溴化鉀與溴化鈉在19世紀末期到二十世紀初期被用作抗癲癇藥與鎮靜劑,
直到他們漸漸地被水合氯醛與巴比妥類藥物所取代。
同位素
溴有兩個穩定的同位素:Br(50.69%)及Br(49.31%)。
其他至少有23種放射性同位素是已被發現可以存在的。
不少的溴同位素是核分裂的產物。
有幾種來自於核分裂產物的大原子量的溴同位素會產生延遲性的中子衰變。
所有的放射性溴同位素的半衰期相對來講是比較短的,半衰期最長的是一個中子數不足的同位素半衰期為2.376天。
半衰期最長的豐中子同位素的半衰期為1.47天。一些溴的同位素有亞穩定的同質異能素。
穩定的Br有一個具放射性的同質異能素,半衰期4.86秒,它最終衰變成穩定的基態。
應用領域
溴可用於製備有機溴化物。溴可用於製備顏料與化學中間體。
溴與氯配合使用可用于水的處理與殺菌。
做氧化劑。有機化合物的溴化劑。乙烯和重碳氫化合物的吸收劑。
水的消毒劑。漂白絲綢纖維。製藥。照相。染料製造。
由於其單質活潑的性質,在自然界中很難找到單質溴。
最常見的形式是溴化物和溴酸鹽。
海藻等水生植物中也有溴的存在,最早溴的發現就是從海藻的浸取液中得到的。
向海水中通氯氣,是比較通用的得到溴和碘的工業途徑。
溴的化合物用途也是十分廣泛的,溴化銀被用作照相中的感光劑。
使用老式相機時,當你“哢嚓”按下快門的時候,相片上的部分溴化銀就分解出銀,從而得到我們所說的底片。
所以很有發展前景。溴在有機合成中也是很有用的一種元素。
在高中的時候我們很多人就做過乙烯使溴水褪色的實驗,這實際上就代表了一類重要的反應。
在製藥方面,有很多藥裡面也是有溴的。
滅火器中也有溴,我們平時看到的諸如“1211”滅火器,就是分子裡面有一個溴原子的多鹵代烷烴,
不僅能撲滅普通火險,在泡沫滅火器無法發揮作用的時候,例如油火,它也能撲滅火險。
醫院裡曾經使用的鎮靜劑,有一類就是用溴的化合物製成的,
如溴化鉀、溴化鈉、溴化銨等,通常用以配成“三溴片”,
可治療神精衰弱和歇斯底里症,但是三溴片已經被更好的藥品(巴比妥類)所取代了。
又如大家熟悉的紅藥水,也是溴與汞的化合物汞溴紅。
此外,青黴素等抗菌素生產也需要溴,溴還是製造農業殺蟲劑的原料。
溴化銀是一種重要的感光材料,被用於製作膠捲和相紙等。
溴在地殼中含量只有0.001%,而且沒有集中形成礦層,無法開採;
而海洋中溴的濃度雖然僅有0.0067%,但它的儲量卻占地球上溴的總儲量的99%,
這樣,人們所需求的溴就只能取自海洋了,這也是溴被稱為“海洋元素”的原因所在。
溴在海洋中,大多是以可溶的化合物形成如溴化鈉、溴化鉀等而存在。
從海水中提取溴,首先要使溴從化合物中脫離出來,變成溴單質。
為此,可以往海水中通氯氣,讓氯置換溴,但這時產生的溴單質仍然溶解在海水中。
這時可以用蒸餾法和空氣吹出法,再經過幾道工序,就能得到液溴。
用濃縮鹽鹵提取溴,比直接用海水要好。
在海水淡化工廠和使用海水冷卻的核電站,同時進行提取溴的生產,經濟上會更為合算。
一個日產10萬噸的淡化水廠,每天要處理15萬噸海水,可得到10萬噸淡水和5萬噸鹵水。
用這些鹵水可提煉10噸溴。
溴的用途很廣,但也是有毒有害物質,所以一些農藥和防爆劑要控制使用。
溴代甲烷對大氣臭氧層可能有一定的影響,這一點已引起科學家們的關注。
許多種的有機溴化物在工業上有其應用,其中一部份是由溴製備而來,另一部份則是由溴化氫製備而來。
而溴化氫則是以在溴中燃燒氫來取得。
加成反應是製備1,2-二溴乙烷的過程,而1,2-二溴乙烷是有機溴化物中被製造的量最多的。C2H4
+ Br2 → CH2BrCH2Br
阻燃物
含溴阻燃劑的重要性與日俱增,當燃燒發生時,阻燃劑會生成氫溴酸,它會干擾在火焰當中所進行的氧化連鎖反應。
高活性的氫、氧與氫氧根自由基會與溴化氫反應成活性沒那麼強的溴自由基。
含溴的化合物可以借由在聚合過程中加入一些被溴化的單體或在聚合後加入含溴化合物的方法加入聚合物中。
添加四溴雙酚A可以製造聚酯與環氧樹脂,用於印刷電路板(PCB)的環氧樹脂通常都是由阻燃劑製成的,
並且在產品縮寫中以FR來表示。(如FR-4與FR-2)溴乙烯可以用來製造聚乙烯、聚氯乙烯與聚丙烯。
十溴二苯醚可以添加在已完成的聚合物中。
汽油添加劑
1,2-二溴乙烷是添加在含鉛汽油中的一種汽油添加劑,它借由產生揮發性的溴化鉛來移除引擎中的鉛,
此類用法在美國占了1966年全部溴用量的77%,但這種用途在1970年代因為會污染環境而被禁止了。
此化合物也曾被當作殺蟲用的熏劑,但此種應用也一樣的被禁止了。
殺蟲劑
溴甲烷曾被廣泛的用做煙薰土地用的農藥,蒙特利爾公約決定到2005年逐漸淘汰這種會破壞臭氧層的化合物。
在1991年,估計有35,000公噸的此化合物被用來對付線蟲動物、真菌、雜草還有一些土壤的問題。
其他用途
鈣、鈉與鋅的溴化物在溴的市場中佔有一席之地,這些鹽類在水裡產生稠密的化合物,
可以用來做鑽井液,有時也被稱做clear brine fluids。
溴也可以用來生產含溴植物油,含溴植物油在許多橘子口味的軟性飲料中當作乳劑。
在此化合物於1940年代被發現後,它被廣泛地使用,直到在1970年代中期,
英國與美國限制了它的使用並且研發出了替代用的乳劑。
但在1997年美國的軟性飲料仍然可以含有含溴植物油。
生理作用
溴在人體中還未找到已知的功能,但有機溴化合物的確自然存在。
海中的有機物是有機溴化合物的主要來源,在1999年有超過1600種化合物被發現。
其中最常見的是溴甲烷,海藻估計製造了56,000公噸的此化合物,夏威夷的蘆筍藻所製成的香精油中就含有80%的溴甲烷。
一個有名且已被人類長時間使用的有機溴化合物是泰爾紫,這種含溴的紫色物質存在於一種體型中等的掠食性海蝸牛:
腹足綱的紫螺蝸牛之中。這種天然的有機溴化合物直到1909年才被保羅·弗裡德蘭德(Paul
Friedländer)所發現。
大部分自然界中的有機溴化合物是由溴化過氧化酶(en:vanadium bromoperoxidase)所產生的。
化合物:
一般指含溴為-1氧化態的化合物。包括金屬溴化物、非金屬溴化物以及溴化銨等。
鹼金屬、鹼土金屬溴化物以及溴化銨易溶于水。難溶溴化物與難溶氯化物相似,
但前者的溶解度通常小於相應的氯化物。溴化氫的水溶液稱為氫溴酸,氫溴酸是一種強酸。
也存在一些屬於溴化物的鹵素互化物,如溴化碘(IBr)。
鹼金屬和鹼土金屬的溴化物可由相應的碳酸鹽或氫氧化物與氫溴酸作用制得。
如:溴化錳、溴化鋇、溴化銅、溴化鎂、溴化鉈、溴化汞等。
毒性
元素狀態的溴是有毒且有刺激性的。
因為溴是一種氧化劑,它不能與大部分的有機或無機化合物穩定的共存,
所以輸送溴時需要謹慎,通常是使用內襯著鉛的鋼制桶子,並以堅固的金屬架支撐。
當某些特定的含溴離子化合物在酸性環境下與高錳酸鉀(KMnO4)混合時,會產生淡棕色的溴霧,
它聞起來像是漂白水,並且對黏膜有很強的刺激性。
一旦有人暴露於其中,他應該立即移動至有新鮮空氣的地方,
如果他出現了某些症狀,那麼他將會需要藥物治療。
吸入低濃度溴後可引起咳嗽、胸悶、粘膜分泌物增加,並有頭痛、頭暈、全身不適等,部分人可引起胃腸道症狀;
吸入較高濃度後,鼻咽部和口腔粘膜可被染色,口中呼氣有特殊的臭味,
有流淚、怕光、劇咳、嘶啞、聲門水腫甚至產生窒息,部分患者可發生過敏性皮炎,
接觸高濃度溴可造成皮膚重度灼傷。
長期吸入溴,可有蓄積性,除表現粘膜刺激症狀外,還伴有神經衰弱綜合征等。
溴氣的預防,主要應做好生產設備及管道密閉,加強局部通風,注意個人防護。
治療,一次誤服大量溴化物者速飲高滲鹽水並探咽導吐,隨即以等滲鹽水洗胃,其後給予硫酸鈉導瀉。
因溴離子在體內分佈與氯離子相同,且可互相替代,二者經由腎臟排泄甚少區別,用氯化物後,
氯離子排出增加,溴離子相應地增加排出,故對中毒病兒,給服適量氯化銨或氯化鈉(食鹽),
對原有心臟病或心衰水腫的患兒,不宜應用大量氯化鈉,可用氯化銨代替。