甲醇乙醇 (剪貼)
甲醇(分子式:CH3OH)又稱羥基甲烷、木醇、木精,是一種有機化合物,是最簡單的醇類。
甲醇獲名為「木醇」,因為它的生產曾經主要是由於木材乾餾的副產品。
現代甲醇是直接從一氧化碳,二氧化碳和氫的一個催化作用的工業過程中被生產。



甲醇很輕、揮發度高、無色、易燃及有一個獨特的氣味非常相似乙醇(飲酒)的氣味。
然而,甲醇不像乙醇,甲醇有劇毒,不可以飲用。通常用作溶劑、防凍劑、燃料或中和劑。
它也可用於經過酯交換反應生產生物柴油。
甲醇可以在空氣中完全燃燒,並釋出二氧化碳及水:
甲醇的火焰也是近乎無色,所以燃點甲醇時要格外小心,以免被燒傷。
不少細菌在進行缺氧新陳代謝之時,都會產生甲醇。因此,空氣中存有少量甲醇的蒸氣,
但幾日內就會在陽光照射之下被空氣中的氧氣氧化,成為二氧化碳。
歷史
古埃及人在遺體保存技術防腐的過程中,使用了包括甲醇的混合物質以保存屍體。
在2006年,天文學家利用射電望遠鏡在焦德雷爾班克天文台的MERLIN陣列,發現了太空中一個2880億英里寬的巨大甲醇雲。
生產
合成甲醇可以用固體(如煤、焦炭),液體(如原油、重油、輕油)或氣體(如天然氣及其他可燃性氣體)做為原料,
經造氣凈化(脫硫)變換,除去二氧化碳,配製成一定的合成氣(一氧化碳和氫)。
在不同的催化劑存在下,選用不同的工藝條件。單產甲醇(分高壓法低壓和中壓法),或與合成氨聯產甲醇(聯醇法)。
將合成後的粗甲醇,經預精餾脫除甲醚,精餾而得成品甲醇。
甲醇是0級醇。
用途
甲醇是一種常見的溶劑。由於它的低的紫外(UV)截止,使得甲醇很有用於高效液相色譜法,
紫外-可見分光光度法及液相色譜法-質譜聯用。
原料
甲醇最大的用途是製造其他化學品。大約40%的甲醇會被轉化為甲醛,再用於生產塑料,膠合板,塗料,炸藥,
和免燙紡織品。
甲醇亦有時會用於更高的份子建構,例如:利用改性高嶺土作催化劑,可以把甲醇脫水生成二甲醚。
科學家基於高嶺土在類似的環境所扮演的催化角式,以及地球創始之時的豐富甲烷環境,推論出地球生命的生成可能從甲醇開始。
汽車燃料
甲醇可以在有限基礎上用作為內燃機的燃料。
其他應用
甲醇是一種傳統的乙醇變性劑,該產品被稱為「變性乙醇」或「甲基化酒精」。
在禁酒時期,這是常用的代替了傳統的乙醇的過程中,部分是因為甲醇比乙醇更便宜。
但其致盲的毒性令甲醇酒精逐漸被取替及規管。
甲醇也作為溶劑使用,並作為在管道的防凍液和擋風玻璃清洗液。
在近年甲醇也成為燃料電池的燃料之一,如
直接甲醇燃料電池。
毒性
甲醇對人體有強烈毒性,因為甲醇在人體新陳代謝中會氧化成比甲醇毒性更強的甲醛和甲酸(蟻酸),
因此飲用含有甲醇的酒可引致失明、肝病、甚至死亡。
誤飲4毫升以上就會出現中毒症狀,超過10毫升即可因對視神經的永久破壞而導致失明,30毫升已能導致死亡。
初期中毒症狀包括心跳加速、腹痛、上吐(嘔)、下瀉、無胃口、頭痛、暈、全身無力。
嚴重者會神智不清、呼吸急速至衰竭。失明是它最典型的症狀,
甲醇進入血液後,會使組織酸性變強產生酸中毒,導致腎衰竭。最嚴重者是死亡。
然而,仍然有不少不法商人不顧人命安全,用含有甲醇的工業酒精勾兌假酒並出售。
但是,真酒中也有極微量的甲醇,是宿醉的原因之一。甲醇中毒可以用乙醇(真酒)解毒。
因為甲醇在肝臟中被酒精脫氫酶氧化成福馬林(甲醛),然後是甲酸。
乙醇可以和甲醇競爭醇脫氫酶,使人體有時間排除甲醇。
…………………………..
乙醇
乙醇(英語:Ethanol,結構簡式:CH
是醇類的一種,是酒的主要成份,所以也俗稱酒精,有些地方俗稱火酒。
化學式也可寫為C2H5OH或EtOH,Et代表乙基。
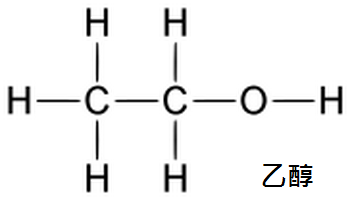
乙醇易燃,一是常用的燃料、溶劑和消毒劑,也用於製取其他化合物。工業酒精含有少量有毒性的甲醇。
醫用酒精主要指體積濃度為75%左右(或質量濃度為70%)的乙醇,也包括醫學上使用廣泛的其他濃度酒精。
歷史
人類很早就會用糖類發酵製造酒精,這也是最早的幾項生物技術之一。
古代人也知道飲酒所帶來的欣快作用,自史前時代開始人類就已開始喝酒,而其中會使人欣快的主要成份就是酒精。
在中國發現的九千年前的陶器,上面就有酒的殘留物,因此當時新石器時代的人已經開始飲酒。
因此麥可·法拉第在1825年無意的發現乙醇可以以乙烯(煤氣中的一種成份)為原料,
利用酸觸媒的水合反應製備,這也類似現在工業製備乙醇的方式。
從1908年起乙醇也是汽車的燃料之一,像福特T型車可以選擇汽油或是酒精做為燃料。
乙醇也是常用酒精燈的燃料之一。
工業用的乙醇一般會用乙烯製備。乙醇常被用做一些人類可能接觸或消耗物質的溶劑,像香水、顏料及醫藥等。
乙醇既是溶劑,也是製造其他物質的原料。乙醇很長的時間都作為可以提供光和熱的燃料,
而最近又開始有研究可以用乙醇為燃料的內燃機。
物理性質
乙醇的物理性質主要與其低碳直鏈醇的性質有關。
分子中的羥基可以形成氫鍵,因此乙醇黏度很大,也不及相近相對分子質量的有機化合物極性大。
室溫下,乙醇是無色,且有特殊香味的揮發性液體。
作為溶劑,乙醇易揮發,且可以與水、乙酸、丙酮、苯、四氯化碳、氯仿、乙醚、乙二醇、甘油、
硝基甲烷、吡啶和甲苯等溶劑混溶。此外,低碳的脂肪族烴類如戊烷和己烷,
氯代脂肪烴如1,1,1-三氯乙烷和四氯乙烯也可與乙醇混溶。
隨著碳數的增長,高碳醇在水中的溶解度明顯下降。
由於存在氫鍵,乙醇具有潮解性,可以很快從空氣中吸收水分。
羥基的極性也使得很多離子化合物可溶於乙醇中,
如氫氧化鈉、氫氧化鉀、氯化鎂、氯化鈣、氯化銨、溴化銨和溴化鈉等。
氯化鈉和氯化鉀則微溶於乙醇。
此外,其非極性的烴基使得乙醇也可溶解一些非極性的物質,
例如大多數香精油和很多增味劑、增色劑和醫藥試劑。
化學反應
乙醇是一種伯醇,連接羥基的碳原子連接二個氫原子。許多乙醇的反應都和羥基有關。
與乙酸反應
乙醇可以與乙酸在濃硫酸的催化下發生酯化作用,生成乙酸乙酯和水。
CH3CH2OH + CH3COOH
→ CH3COOCH2CH3
+ H2O
乙醇可以在有酸的催化下和其它羧酸發生酯化作用,生成相應的酯類和水。
RCOOH + HOCH2CH3
→ RCOOCH2CH3 +
H2O
若是在化工產業中大規模的進行此反應,需設法生成物中移除水。
酯類和酸或鹼反應會產生醇類和鹽,肥皂製作也是利用此反應的原理,因此稱為皂化反應。
乙醇也會和無機酸形成酯類,像硫酸二乙酯和磷酸三乙酯,是將乙醇和三氧化硫及五氧化二磷反應而得。
硫酸二乙酯是有機合成中常用的乙基化試劑。
硝酸乙酯是將硝酸鈉和乙醇和硫酸反應而得,以前常當作利尿劑。
還原性
乙醇具有還原性,可以被氧化成為乙醛。
酒精中毒的罪魁禍首通常被認為是有一定毒性的乙醛,而並非喝下去的乙醇。
例如:
燃燒:乙醇可以與空氣中氧氣發生劇烈的氧化反應產生燃燒現象,生成水和二氧化碳。
CH3CH2OH + 3O2
→ 2CO2 + 3H2O
乙醇也可與濃硫酸跟高錳酸鉀的混合物發生非常激烈的氧化反應,燃燒起來。
鹵化反應:乙醇(C2H5OH)可以和鹵化氫發生取代反應,生成鹵代烴和水(H2O)。
例如:CH
乙醇的鹵代反應也可以和更強的鹵化劑反應,
比如氯化亞碸或三溴化磷:CH
乙醇在鹼性條件下與鹵素反應,最終產物會是鹵仿 (CHX3,X = Cl, Br, I),
這一過程稱為鹵仿反應。
其反應中間產物是三氯乙醛:
脫水反應
乙醇可以在濃硫酸和高溫的催化發生脫水反應,隨著溫度的不同生成物也不同。
如果溫度在
如果溫度在
酸鹼反應
與活潑金屬反應:
乙醇可以和活潑性金屬反應,生成醇鹽和氫氣。
例如與鈉的反應:
也可以和一些非常強的鹼,比如氫化鈉反應:CH
乙醇的酸性和水接近,兩者的pKa分別為16和15.7,
因此醇鹽和鹼存在如下化學平衡:CH
工業製法
工業上一般用澱粉發酵法或乙烯的水化法製取乙醇。
在一定條件下,乙烯通過固體酸催化劑直接與水反應生成乙醇:CH2=CH2+H2O→CH
上述反應是放熱、分子數減少的可逆反應。
殺菌效果
乙醇可使蛋白質變性,但是由於純乙醇無法滲透到細胞壁內層,故純乙醇的殺菌效果不好。
體積濃度75%的乙醇用於醫用消毒,同樣,碘酊(俗稱碘酒)的溶劑也是乙醇。
酒精的濃度太高,反而馬上使細菌表面的蛋白質凝固了,結果形成一層硬膜。
這層硬膜對細菌有保護作用,防止酒精進一步滲入,所以濃酒精(95%)消毒殺菌效果,反而不及稀酒精(70~75%濃度最佳)
健康
高濃度的乙醇會刺激皮膚和眼球,若食用過量則導致嘔吐及噁心。長期食用則會損害肝臟。
毒性比較
關於常見管制藥品的傷害性及成癮性比較可參見右圖,作為參照,煙、酒也列於其中。
從圖中可見,酒精對身體造成的生理傷害和依賴性,比大麻和搖頭丸來的嚴重,不如古柯鹼、海洛英來的嚴重。
致癌性
含酒精的飲料被世界衛生組織歸類為1類致癌物(對人體有明確致癌性的物質或混合物)。
藥性
在中國傳統醫藥觀點上,乙醇有促進人體吸收藥物的功能,並能促進血液循環,治療虛冷症狀。
漱口水如果含有較高濃度的酒精,就算不吞入也可能有害健康。
乙醇先轉為乙醛,乙醛再放大神經遞質GABA的作用。